在开始之前不得不提的是9月13日新版CDE网站上线的新闻,eCTD版块的正式推出着实在国内注册圈引起了不小的轰动。中国eCTD时代真的要开启了么?我们做好准备了吗?我们暂且不管中国eCTD何时上线,在这里解读下近期美国的法规以求望梅止渴。
首先最值得一提的是近期FDA官网的一则通知如左下:
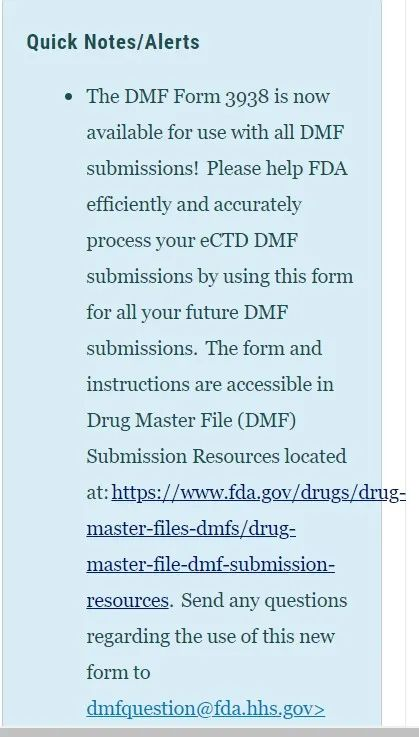

如大家所见,这则通知明确提到DMF申报里以后将使用一种名为3938的表格,这让多年来不填表格“裸奔”的DMF申报也拥有了自己的身份证(如右图),3938表格共三页,需填报的信息非常齐全,让DMF申报在标准化合规化的道路上更进了一步。
其次,迈入4.0时代以来,US eCTD 的验证标准频繁更新如下:

从几版变更中不难看出,1553的出镜率最高,四次更新共有三次涉及,其内容如下:

本条规则连同1551、1554从3.9被引入开始,旨在树立2253类递交的规范,包括在本类递交中只能递交2253 Form,应在1.14.6中提交最新的Product Labeling和Promotional Material Issue Date的格式规范应为YYYYMMDD三方面内容。
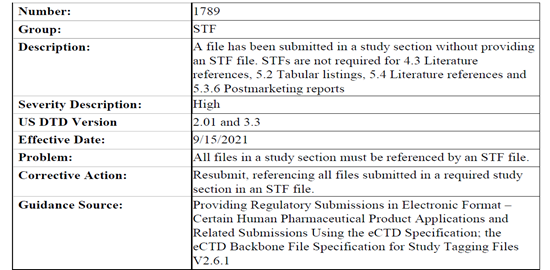
1734-1737四条已于9月15日生效,均为对于datasets文件的规范,其中涉及xpt和xml文件的正确使用和明确了datasets文件的标签属性,1789更是强调了每个study section文件都应拥有自己的标签(特殊章节如4.3,5.2,5.4等除外)。
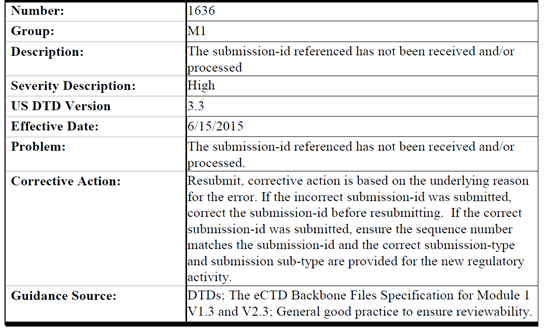
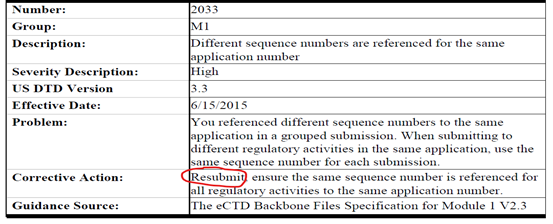
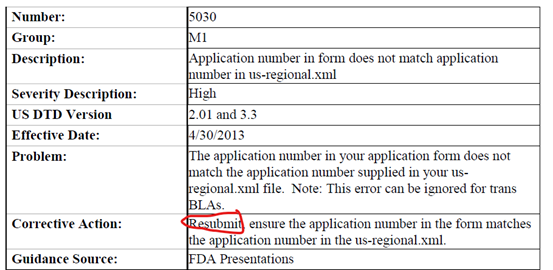
而8月16日最近的一次更新,除1306和1323两条关于leaf element的法规要到2022年生效外,1636到5030共四条有关corrective action的更新中Resubmit字样不可谓不惹眼,希望广大注册同仁一定对以下规则提起高度重视以免耽误递交:
递交前一定记得用最新版的Rosetta中集成的验证器仔细验证,如有任何软件更新和修复问题请及时联系我们!
为迎接中国药品研发信息化时代的到来,DoubleBridge(以下简称DB)以北京和桥软件技术有限公司新形象登陆中国,将Rosetta eCTD系列软件以“金字塔eCTD”的中国本土新品牌服务国内客户。DB于1997年在美国创立,总部坐落于美国东岸的新泽西州普林斯顿,在普林斯顿、北京、西安和印度设有研发中心,服务全球,现有技术人员约300人。专注为医药研发信息化领域提供专业的解决方案。现有全球超过400余家活跃客户,包括全球前20大制药公司。北京和桥软件立志用信息化手段提升中国制药研发合规性、效率和智能水平,为增强中国药品研发水平贡献力量!
电话:010-82101315
官网:www.heqiaosoft.com
邮箱:info@heqiaosoft.com
微博:@北京和桥软件技术有限公司
地址:北京市朝阳区十里河德元九和大厦2楼
西安研发中心:
咨询:+86 138-1177-9419
联系邮箱:yajun.zhang@qxutech.com


