发布日期:20200921
为加快推进eCTD系统建设,我中心根据《药品注册管理办法》和《M4模块一行政文件和药品信息》等相关配套文件的最新要求,对前期形成的《eCTD申报指南(征求意见稿)》、《eCTD技术规范(征求意见稿)》和《eCTD验证标准(征求意见稿)》进行了修改和完善,现再次向社会公开征求意见。
欢迎社会各界提出宝贵意见和建议,请按照《反馈意见模板》要求于2020年10月21日前通过电子邮件反馈至我中心。
联系人:李海玲
电子邮箱:lihl@cde.org.cn
国家药品监督管理局药品审评中心
2020年9月21日
附表:文件列表
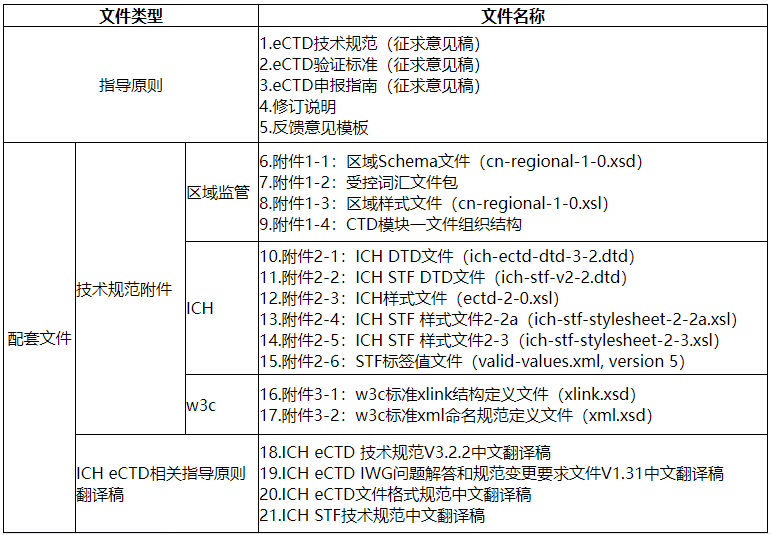
1 :eCTD技术规范(征求意见稿).pdf附件
2 :eCTD验证标准(征求意见稿).pdf附件
附件 3 :eCTD申报指南(征求意见稿).pdf
附件 4 :修订说明.pdf
附件 5 :反馈意见模板.xls
附件 6 :技术规范附件(压缩包).zip
附件 7 :ICH eCTD相关指导原则翻译稿(压缩包).rar
西安研发中心:
咨询:+86 138-1177-9419
联系邮箱:yajun.zhang@qxutech.com


